
Reações químicas Endotérmicas e Exotérmicas
Reação Endotérmica é aquela em que há absorção de energia. Nesse processo, a energia é produzida e, de forma independente, é mantida.
As aves e os mamíferos têm a capacidade de manter a estabilidade da temperatura do corpo. Por esse motivo eles são chamados de animais endotérmicos, popularmente, “animais de sangue quente”.
Reação Exotérmica é aquela em que há liberação de energia. Nesse processo, a produção de energia somente persiste mediante o fornecimento contínuo de energia.
A mudança de estados físicos, nessa ordem: gasoso, líquido e sólido, é um exemplo de reação exotérmica. Cada um deles ocorre na medida em que a energia é liberada, ou seja, quando há menos calor.
Repare que ao invertemos essa ordem (sólido, líquido e gasoso), existe produção de energia (mais calor). Neste caso, a reação é endotérmica.
O que é um reagente ?
Que determina a presença de certo elemento numa reação química; diz-se do produto químico que provoca uma reação ou determina a presença desse elemento.
O que é um produto ?
Um produto químico é formado por um ou mais compostos químicos que lhe permitem cumprir com uma determina função.
Lei da conservação das massas
ou
Lei de Lavoisier
A Lei de Lavoisier,postulada em 1785 pelo químico francês Antoine Laurent Lavoisier (1743-1794), corresponde a Lei da Conservação das Massas. Considerado o Pai da Química Moderna, segundo ele: “Na natureza nada se cria, nada se perde, tudo se transforma”.
Isso explica que as substâncias químicas quando reagem, não são perdidas, ou seja, se transformam em outras, de forma que esses elementos ainda permanecem, no entanto de forma diferente, pois seus átomos são rearranjados.
As equações químicas são uma forma gráfica de observar essa transformação, por exemplo, na formação do gás carbônico:
C + O → CO2
A Lei da Conservação das Massas ou Lei de Conservação da Matéria, proposta por Lavoisier postula que:
"A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação."
Para chegar nessas conclusões, Lavoisier utilizou balanças precisas, envolvendo diversos elementos em recipientes fechados, cujas massas totais dos elementos não variavam antes (reagentes) e depois da reação (produtos), permanecendo constantes.
Note que se ele realizasse suas experiências num ambiente aberto haveria uma perda de massa, posto que a substância reagiria com o ar. Nesse caso, se observarmos um ferro que com o passar do tempo reage com o ar (resultando na ferrugem), notamos a variação em sua massa inicial, ou seja, ela torna-se maior após o contato entre eles uma vez que apresenta a massa do ferro e a massa do ar. Assim, fica claro que a Lei de Lavoisier é somente aplicada em sistemas fechados.
Catálises
Catálise é a denominação dada à reação que ocorre na presença de um catalisador.
Catalisador é a espécie química que faz com que as moléculas reagentes reajam com uma velocidade maior, ou seja, eles aceleram a reação. Se reunirmos estas duas definições poderíamos conceituá-las do seguinte modo:
Catalisadores são espécies químicas que possuem a propriedade de aumentar a velocidade de uma reação sem que esta sofra alterações permanentes, tanto no que diz respeito à composição química como à quantidade. Catálise é o nome dado a estas reações que acontecem na presença de catalisadores.
Existe 2 tipos de Catálise:
Catálise homogênea: nesta catálise, o catalisador e os reagentes constituem uma única fase.
NO (g)
2 SO2 (g) + O2 (g) → 2 SO3 (g)
Catalisador da reação: NO gasoso.
Reagentes: SO2 gasoso e O2 gasoso.
Observe que o catalisador e os reagentes possuem uma só fase (gás), ou seja, o sistema é monofásico.
Catálise heterogênea: o catalisador e os reagentes possuem mais de uma fase neste tipo de catálise.
Pt (s)
2 SO2 (g) + O2 (g) → 2 SO3 (g)
Catalisador da reação: Pt sólido.
Reagentes: SO2 gasoso e O2 gasoso.
Neste caso o sistema é formado pela mistura de SO2, O2 e Pt, sendo assim é difásico porque possui duas fases: gás e sólido.
sites: https://www.todamateria.com.br/lei-de-lavoisier/, http://mundoeducacao.bol.uol.com.br/quimica/catalise.htm
Tabela Tabela Periódica
A tabela periódica dos elementos ,ou simplesmente tabela periódica, é um
esquema que é utilizado para classificar e organizar os elementos químicos
mostrando as funções de suas propriedades e características próprias .
organizando os em colunas como a imagem abaixo
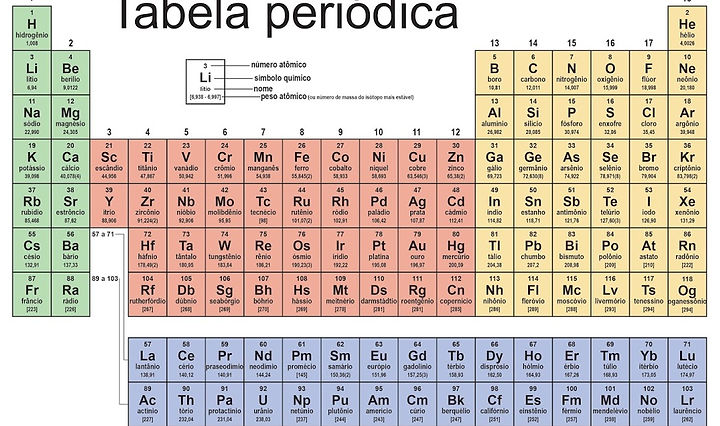
FONTE:APOSTILA ESCOLAR
Uma experiência :A serpente do faraó
.Material utilizado : açúcar ,bicarbonato de sódio ,álcool areia , recipiente ,liquidificador e recipiente para o fogo
.Preparo :coloque no recipiente uma colher de bicarbonato, quatro de açúcar e misture .
Corte uma ponta de garrafa e coloque a mistura do açúcar e bicarbonato de sódio no bico da garrafa e despeje gotas de álcool e prense o máximo possível.Espere secar e retire da boca da garrafa, pegue outro recipiente coloque areia, depois os cilindros da mistura da garrafa e acrescente mais álcool e ascenda utilizando um isqueiro ou um palito de fosforo.
Sua serpente aparecerá ,mas só faça isso com a ajuda de um adulto se for menor de 18 anos
Veja a imagem pra saber como fica

